È stato approvato dall’EMA (European Medicines Agency) il vaccino anti-Covid19 prodotto dalla ditta americana Moderna, il secondo a ottenere l’approvazione europea, dopo quello nato dalla cooperazione delle aziende Biontech e Pfizer e somministrato in Italia a partire dallo scorso 27 dicembre. Si tratta, come il Comirnaty (Pfizer-Biontech), di un vaccino a mRNA, che fornisce il materiale genetico (piccoli segmenti di RNA) necessario a codificare la proteina spike del SARS-CoV-2 (quella che apre al virus l’ingresso alle cellule) in quantità sufficiente per stimolare la produzione di anticorpi e, quindi, la protezione immunitaria contro il Covid-19.
Potrà ora partire la somministrazione anche in Italia di questo vaccino, mentre si è in attesa dell’approvazione di altri tipi di vaccini, differenti da quelli a mRNA della Pfizer e di Moderna. Si prevede infatti per marzo l’approvazione da parte dell’EMA di un terzo vaccino, sviluppato da AstraZeneca e dall’Università di Oxford, che, contrariamente ai due precedenti, non sarà un vaccino a RNA messaggero, ma conterrà il virus dell’influenza A vivo e attenuato (indebolito). La sua efficacia protettiva è alta sin dalla prima somministrazione (70%) e raggiunge il 90% di efficacia alla seconda (i vaccini Pfizer e Moderna hanno mostrato tuttavia un’efficacia al 95% in seguito alle due dosi). Si tratta di un’efficacia decisamente notevole, se la si confronta con quella dei normali vaccini influenzali, che si aggira sui 67% per il virus A (H1N1), 42% per il virus B e solo 25% per il virus A (H3N2).
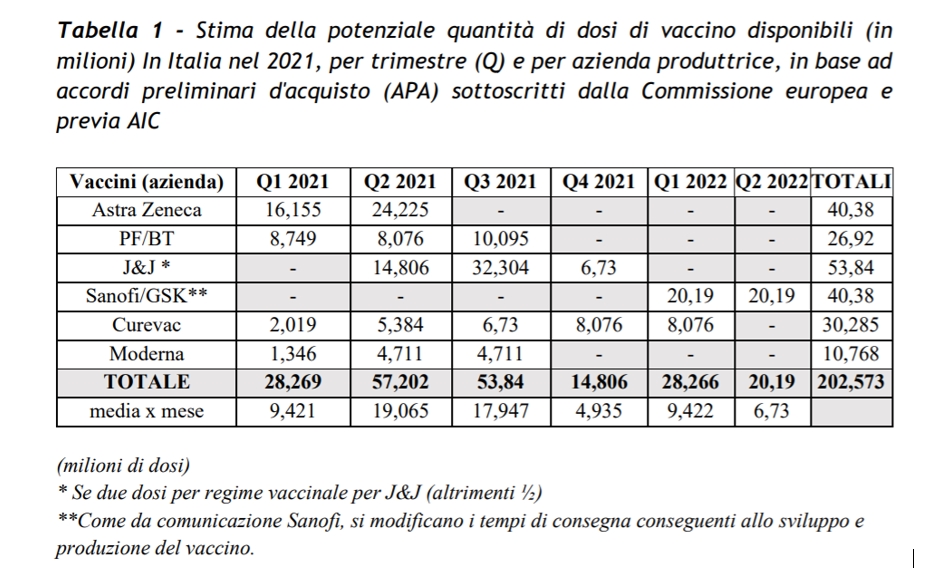
Secondo il Piano strategico per la vaccinazione anti-SARS-CoV-2/COVID-19 approvato dal Ministero della Salute italiano sono previsti entro la fine dell’anno altri tre vaccini anti-Covid19, il vaccino della Curevac (ancora un mRNA, atteso entro la fine del primo trimestre 2021) e quello della Johnson&Johnson, un vaccino a DNA atteso per il secondo trimestre di quest’anno. Il piano di vaccinazioni prevede entro il 2022 la disponibilità di 200mila vaccini diversi (mRNA, DNA, influenzale vivo attenuato), prodotti e commercializzati da almeno aziende farmaceutiche differenti.
Alla corsa ai vaccini, iniziata all’inizio dello scorso anno, partecipavano inizialmente un grande numero gruppi di ricerca tra istituti privati, ditte farmaceutiche ed enti pubblici, che potevano avvalersi, per il primo step della ricerca, dei risultati delle indagini avviate più di un decennio fa per i virus della prima SARS e della MERS. Questo è uno dei motivi per cui la prima fase della ricerca del vaccino anticovid ha potuto procedere più velocemente del solito (sarebbero stati necessari almeno 2-3 anni o forse di più, se si fosse dovuto partire da zero). Dei quasi 180 candidati vaccini anti-covid esaminati nella fase pre-clinica, circa 2/3 hanno avviato la sperimentazione clinica, che si compone di tre fasi. Di questi, la maggior parte sono fermi alle fasi una o due, mentre una ristretta cerchia di candidati sono passati alla fase tre. Per produrre un vaccino solitamente le tre fasi si svolgono in maniera consecutiva, ma la novità del vaccino anticovid consiste nello svolgimento in parte in contemporanea delle tre fasi e di un avvio della produzione per la commercializzazione (a rischio della ditta) ancor prima della fine della terza fase e, soprattutto, dell’autorizzazione da parte degli enti predisposti (FDA, EMA). Solitamente questa approvazione arriverebbe dopo anni (anche decenni) dall’inizio della produzione del vaccino. Si capisce che il modo completamente nuovo in cui si sta procedendo stavolta sia dettato da un’emergenza globale che ha portato i ricercatori e le ditte farmaceutiche a procedere in maniera differente al fine di arrivare a un vaccino definitivo in un periodo relativamente breve (tra i 10 mesi e l’anno e mezzo).

Questo significa che i vaccini che ottengono le certificazioni hanno superato tutti gli step in maniera decisamente più veloce del solito (superato a pieni voti per quanto riguarda gli effetti a “breve termine”, altrimenti la certificazione non potrebbe aver luogo), ma che si tratta comunque di un’approvazione di emergenza, data la mancanza di una sperimentazione che consenta di osservare gli effetti non a breve termine, ma a medio e lungo termine (a distanza di 5 o 10 anni).
Le certificazioni FDA o EMA attestano che i vaccini sono efficaci, che sono sicuri, che non si sono verificati casi di decessi durante le sperimentazioni (o, perlomeno, non si sono verificati decessi in numero significativo: è emblematico il caso del vaccino Pfizer in cui i decessi del gruppo placebo sono stati il doppio, cioè 4, dei decessi nel gruppo dei vaccinati, cioè 2, su un totale di 200mila persone per ciascun gruppo – quindi comunque 0,0%), che non si sono verificate specifiche reazioni ai vaccini di tipo medio-grave o grave (la reazione più grave, ancora sotto osservazione, è il numero di casi di paralisi di Bell sia nel gruppo dei vaccinati Pfizer, sia nel vaccinati con Moderna; ma ancora, la percentuale dei casi riscontrati è inferiore all’incidenza che la paralisi di Bell ha in media in una popolazione normale, cioè 20 casi ogni 100mila abitanti).
Con ciò si è voluto mostrare che:
- non esiste un solo vaccino e non esiste un solo tipo di vaccino, ma sono state sviluppate varie metodologie per la produzione dei vaccini anti-covid;
- sperimentazione e controllo vanno di pari passo sempre, anche qualora l’emergenza Covid-19 ha richiesto agli enti di ricerca di accelerare le indagini e le sperimentazioni;
- la ricerca continua e non si ferma di certo nel momento in cui sono partite le somministrazioni di massa; è importante che possa continuare liberamente, su più fronti e senza pressioni e che, una volta che si abbiano a disposizione nuovi risultati, vengano resi pubblici e fruibili da tutti.






